
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Внешнее дыхание
|
|
Структура воздухоносных путей (ВП) и паренхимы легких. Воздухоносные (или дыхательные) пути соответственно их положению в теле подразделяют на верхние и нижние. К верхним ВП относят полость носа, носовую часть глотки, ротовую часть глотки, к нижним ВП - гортань, трахею, бронхи, включая внутрилегочные разветвления бронхов. Увлажнение и фильтрация вдыхаемого воздуха осуществляется в верхних дыхательных путях (в носу, во рту и в глотке).
Нижние воздухоносные пути представляют собой систему дихотомически ветвящихся трубок (каждый бронх разветвляется на два меньших бронха). Хотя диаметр каждой дочерней ветви меньше диаметра родительской трубки, от которой она берет начало, общая площадь поперечного сечения каждой последующей генерации ВП возрастает из-за значительного увеличения общего числа ветвей.
В легком человека насчитывается в среднем 23 генерации ВП (рис. 3.1). Первые 16 называют проводящими, так как они обеспечивают поступление газа к зонам легких, где происходит газообмен. Поскольку в проводящих воздухоносных путях нет альвеол и, следовательно, они не могут участвовать в газообмене, в совокупности образуемую ими емкость называют анатомическим мертвым пространством. Объем его составляет около 150 мл. Проводящие ВП включают бронхи, бронхиолы и терминальные бронхиолы. Последние семь генераций ВП состоят из дыхательных бронхиол, альвеолярных ходов и альвеолярных мешочков. Каждое из этих образований дает начало альвеолам. Дыхательная бронхиола первого порядка (Z=17) и все дистально расположенные от нее газообменивающие ВП образуют легочный ацинус.

Рис. 3.1. Упрощенная схема воздухоносных путей человека (по E.R. Weibel, 1963).
Вдыхаемый воздух продвигается примерно до конечных бронхиол по механизму объемного потока дистальнее, однако из-за возрастания общей площади поперечного сечения ВП, вследствие многократных ветвлений, поступательное перемещение газов становится очень незначительным. Главным механизмом вентиляции в дыхательной зоне является диффузия газов.
Стенки трахеи и бронхов состоят из трех основных слоев: внутренней слизистой оболочки; гладкомышечного слоя, отделенного от слизистой соединительнотканной подслизистой прослойкой; и внешнего соединительнотканного слоя, содержащего в больших бронхах и трахеи хрящ.
Бронхиальный эпителий является псевдослоистым, состоящим из высоких и низких базальных клеток, каждая из которых прикреплена к базальной мембране. При каждом делении элементов трахеобронхиального дерева характер эпителия их слизистой оболочки и подлежащих структур постепенно меняется. Эпителий переходит от реснитчатого столбчатого к кубическому и затем к плоскому альвеолярному. Газообмен может осуществляться только через плоский эпителий, который появляется в дыхательных бронхиолах (бронхи 17-19-го порядка). Эпителиальные клетки ВП несут на своей апикальной поверхности реснички, которые являются важными элементами мукоцилиарной системы. Реснички столбчатого и кубического эпителия синхронно колеблются в направлении носоглотки, продвигая защитный слой слизи, секретируемой бокаловидными клетками, расположенными между реснитчатыми клетками эпителия.
Гладкая мускулатура ВП, собранная в непрерывные пучки внутри соединительнотканной подслизистой прослойки, простирается от главных бронхов до дыхательных бронхиол. Мышечные пучки проникают также в газообменные зоны, располагаясь в стенках у входа в альвеолы.
Стенки дыхательных путей постепенно теряют хрящевую основу (в бронхиолах) и гладкую мускулатуру. Утрата хрящевой основы приводит к тому, что с уменьшением диаметра проходимость дыхательных путей становится зависимой от радиального растяжения, обусловленного эластическими структурами окружающих тканей. Вследствие этого диаметр мелких дыхательных путей определяется общим объемом легких.
Из общей емкости легких (5 л) большая часть (около 3 л) приходится на дыхательную (газобменную) зону. Она включает около 300 млн. альвеол. Поверхность альвеолярно-капиллярного барьера составляет 50-100 м2, а толщина - 0, 5 мкм. Эпителий, выстилающий внутреннюю поверхность альвеолы, состоит из двух типов клеток: плоских выстилающих (I тип) и секреторных (II тип) Клетки первого типа занимают до 95% площади альвеолярной поверхности. Клетки второго типа продуцируют и секретируют сурфактант, состоящий из протеинов и фосфолипидов. Он распределяется по альвеолярной поверхности и снижает поверхностное натяжение. Эндотелий капилляров также состоит из слоя плоских выстилающих клеток, располагающихся на эндотелиальной базальной мембране. В зоне альвеол базальные мембраны эпителия и эндотелия спаяны друг с другом, что создает сверхтонкий барьер для обмена газов. В отличие от тесного контакта соседних эпителиальных клеток, образующих непроницаемый барьер, соединения между эндотелиальными клетками довольно слабые. Это позволяет воде и растворенным в ней веществам перемещаться между плазмой и интерстициальным пространством (рис. 3.2).
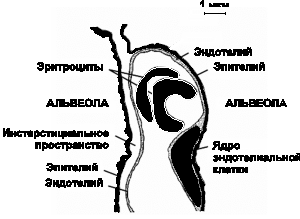
Рис. 3.2. Альвеолярно-капиллярная мембрана. Показаны легочное интерстициальное пространство с капилляром, проходящим между двумя альвеолами. Капилляр выпячивается в просвет расположенной справа альвеолы через ее тонкую (газообменную) стенку. Интерстициальное пространство сливается с толстой стенкой левой альвеолы (по J.F. Nunn, 1987)
Механика дыхания - область физиологии дыхания, которая рассматривает силы, ответственные за движения потока воздуха внутрь грудной клетки и обратно.
Для того чтобы обеспечить поглощение кислорода и выделение двуокиси углерода, свежий воздух должен постоянно доставляться к альвеолам с помощью дыхательного насоса.Понимание механизма действия дыхательного насоса, обеспечивающего поток газа в легкие, требует рассмотрения функции дыхательных мышц, свойств ВП, грудной клетки и легких, которые определяют импеданс системы дыхания, а также причин неравномерности вентиляции и других факторов.
При спонтанном дыхании активность дыхательных (инспираторных) мышц необходима для преодоления импеданса дыхательной системы (эластичность × сопротивление). Важнейшей мышцей вдоха является диафрагма. К ней подходят нервы от 3-го, 4-го и 5-го шейных сегментов спинного мозга. При сокращении диафрагмы органы брюшной полости смещаются вниз и вперед, вследствие чего вертикальные размеры грудной полости возрастают. Кроме того, при этом поднимаются и расходятся ребра, приводя к увеличению ее поперечника. При спокойном дыхании диафрагма смещается примерно на 1 см, а при форсированном амплитуда ее движений может достигать 10 см. Поскольку диафрагма имеет куполообразную форму, особое значение приобретает отношение между давлением, напряжением и радиусом ее кривизны. В соответствие с законом Лапласа оно описывается следующим уравнением:
 (3.2),
(3.2),
где: Р- давление создаваемое мышцей,
Т - напряжение мышцы,
r - радиус кривизны.
По мере уплощения диафрагмы радиус ее кривизны увеличивается и генерируемое давление снижается. Это явление, например, вместе с укорочением мышцы обусловливает снижение силы диафрагмы у пациентов с хронической обструктивной болезнью легких.
При спокойном дыхании диафрагма является единственной активной инспираторной мышцей. При необходимости увеличения вентиляции, например при физической нагрузке или болезненных состояниях, подобных бронхиальной астме, активизируются и другие мышцы. К ним относятся наружные межреберные, лестничные и грудино-ключично-сосцевидные. Две последние группы мышц называются дополнительными дыхательными мышцами.
В отличие от вдоха, выдох в нормальных условиях в состоянии покоя происходит пассивно. Эластическая отдача легких и грудной стенки обеспечивает возникновение градиента давления, достаточного для экспираторного потока. При обструкции ВП выдох становится активным процессом, требующим работы экспираторных мышц, включая внутренние межреберные и брюшные (наружную и внутреннюю косою, поперечную брюшную и прямую брюшную).
Сокращение инспираторных мышц создает градиент давления между атмосферой и альвеолами, в результате чего возникает поток воздуха. Этот градиент преодолевает: (1) эластическую отдачу дыхательной системы, (2) фракционное сопротивление ВП воздушному потоку и (3) инерционное сопротивление трахеобронхиального воздушного столба, легких и грудной стенки. Взаимоотношения этих трех элементов выражаются уравнением движения легких:
 (3.3),
(3.3),
где: P - движущее давление;
E - эластичность;
DV - изменение объема легких;
R - сопротивление;
V ’- объемная скорость потока воздуха;
I - инерционность;
V’’ - скорость изменения объемной скорости воздушного потока (ускорение).
Таким образом, механические свойства системы дыхания, от которых зависит эластическое и неэластическое сопротивление воздушному потоку, определяют необходимое движущее давление.
В норме основная работа дыхательных мышц затрачивается на преодоление эластического сопротивления легких и грудной клетки. Причем, отношение между давлением и изменением объема легких не остается постоянным во всем диапазоне легочных объемов. При их малой величине это отношение может быть выражено как:
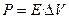 (3.4),
(3.4),
где: Е - эластичность;
DV - изменение объема легких.
Эластичность - есть мера упругости легочной ткани. Чем больше эластичность ткани, тем больше давления требуется приложить для достижения заданного изменения объема легких. Эластическая тяга легких возникает благодаря высокому содержанию в них эластиновых и коллагеновых волокон. Эластин и коллаген находятся в альвеолярных стенках вокруг бронхов и кровеносных сосудов. Возможно, упругость легких обусловлена не столько удлинением этих волокон, сколько изменением их геометрического расположения, как это наблюдается при растяжении нейлоновой ткани: хотя нити сами по себе не изменяют длины, ткань легко растягивается благодаря их особому переплетению.
Определенная доля эластической тяги легких обусловлена также действием сил поверхностного натяжения на границе " газ-жидкость" в альвеолах. Поверхностное натяжение - это сила, возникающая на поверхности, разделяющей жидкость и газ. Она обусловлена тем, что межмолекулярное сцепление внутри жидкости гораздо сильнее, чем силы сцепления между молекулами жидкой и газовой фазы. В результате этого площадь поверхности жидкой фазы становится минимальной. Силы поверхностного натяжения в легких взаимодействуют с естественной эластической отдачей, обеспечивая спадение альвеол.
Специальное вещество (сурфактант), состоящее из фосфолипидов и протеинов и выстилающее альвеолярную поверхность, снижает внутриальвеолярное поверхностное натяжение. Сурфактант секретируется альвеолярными эпителиальными клетками II типа и выполняет несколько важных физиологических функций. Во-первых, понижая поверхностное натяжение, он увеличивает растяжимость легкого (уменьшает упругость). Тем самым уменьшается совершаемая при вдохе работа. Во-вторых, обеспечивается стабильность альвеол. Давление, создаваемое силами поверхностного натяжения в пузырьке (альвеоле), обратно пропорционально его радиусу, поэтому при одинаковом поверхностном натяжении в мелких пузырьках (альвеолах), оно больше, чем в крупных. Эти силы также подчиняются закону Лапласа, упомянутому ранее (1), с некоторой модификацией: «Т» - поверхностное натяжение, а «r» - радиус пузырька.
В отсутствие природного детергента мелкие альвеолы стремились бы перекачать свой воздух в более крупные (рис. 3.3.). Поскольку при изменении диаметра меняется слойная структура сурфактанта, его эффект в отношении снижения сил поверхностного натяжения проявляется тем больше, чем меньше диаметр альвеол. Последнее обстоятельство сглаживает эффект меньшего радиуса кривизны и увеличенного давления. Тем самым предотвращается спадение альвеол и появление ателектазов на выдохе (диаметр альвеол минимален), а также перемещение воздуха из меньших альвеол внутрь больших альвеол (за счет выравнивания сил поверхностного натяжения в альвеолах разного диаметра).

Рис. 3.3. При данном поверхностном натяжении газ из меньшей альвеолы будет перемещаться в большую, поскольку меньший радиус кривизны (r1< r2) создает более высокое давление (Р1> Р2) в меньшей альвеоле (закон Лапласа)
Респираторный дистресс-синдром новорожденных характеризуется дефицитом нормального сурфактанта. У больных детей легкие становятся ригидными, неподатливыми, склонными к коллапсу. Дефицит сурфактанта имеется и при респираторном дистресс-синдроме взрослых, однако, его роль в развитии этого варианта дыхательной недостаточности менее очевидна.
Давление, создаваемое эластической паренхимой легкого называется давлением эластической отдачи (Pel). В качестве меры эластической тяги обычно используют растяжимость (С - от англ. complianсе), которая находится в реципрокном отношении к эластичности:
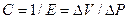 (3.5),
(3.5),
где: С - растяжимость (комплайнс);
Е - эластичность (см. 3.4).
Растяжимость (изменение объема на единицу давления) отражается наклоном кривой объем-давление. Из рис. 3.4 видно, что такие кривые при раздувании и спадении легких неодинаковы - при одном и том же давлении объем спадающихся легких больше, чем во время их раздувания. Подобные различия между прямым и обратным процессом называются гистерезисом. Кроме того, видно, что кривые не исходят из начала координат. Это указывает на то, что легкое содержит небольшой, но измеримый объем газа даже тогда, когда на него не действует растягивающее давление.

Рис. 3.4. Кривая объем-давление
Растяжимость обычно измеряется в статических условиях (Сstat), т. е. в состоянии равновесия или, другими словами, в отсутствии движения газа в дыхательных путях. Динамическая растяжимость (Cdyn), которую измеряют на фоне ритмичного дыхания, зависит еще и от сопротивления дыхательных путей. При нормальном сопротивлении ВП Cdin близка к величинам Cstat и слабо зависит от частоты дыхания. При увеличении сопротивления ВП, даже когда оно невелико, Cdyn может снизиться (особенно при высокой частоте дыхания). Эти изменения Cdin, зависящие от частоты дыхания, называют частотно-зависимой растяжимостью.
В физиологических условиях статическая растяжимость легких человека при небольшом давлении (5-10 см Н2О) достигает примерно 200 мл/см вод. ст. При более высоких давлениях (объемах) она, однако, уменьшается. Этому соответствует более пологий участок кривой объем-давление. Растяжимость легких несколько снижается при альвеолярном отеке и коллапсе, при повышении давления в легочных венах и переполнении легких кровью, при увеличении объема внесосудистой жидкости, наличии воспаления или фиброзе. При эмфиземе легких растяжимость возрастает, как считают, за счет утраты или перестройки эластических составляющих легочной ткани (рис. 3.5.).

Рис. 3.5. Кривые объем-давление у здоровых и больных людей
Растяжимость грудной клетки в норме составляет около 200 мл/см вод. ст. Эластическая тяга грудной клетки объясняется наличием структурных компонентов, противодействующих деформации, возможно, мышечным тонусом грудной стенки. Вследствие наличия эластических свойств, грудная клетка в состоянии покоя имеет тенденцию к расширению, а легкие - к спадению, т.е. на уровне функциональной остаточной емкости легких (ФОЕ) эластическая отдача легкого, направленная внутрь, уравновешивается эластической отдачей грудной стенки, направленной наружу. По мере того как объем грудной полости от уровня ФОЕ расширяется до уровня ее максимального объема (общая емкость легких, ОЕЛ), направленная наружу отдача грудной стенки снижается. При уровне 60% жизненной емкости легких, измеряемой на вдохе (максимальное количество воздуха, которое можно вдохнуть, начиная с уровня остаточного объема легких), отдача грудной клетки падает до нуля. При дальнейшем расширении грудной клетки отдача ее стенки направляется внутрь (рис. 3.6.). Большое количество клинических нарушений, включая выраженное ожирение, обширный плевральный фиброз и кифоскалиоз, характеризуются изменениями растяжимости грудной клетки.

Рис. 3.6. Направление вектора эластической отдачи грудной клетки в зависимости от дыхательного объема
В клинической практике обычно оценивается общая растяжимость легких и грудной клетки (Собщая). В норме она составляет около 0, 1 см/вод. ст. и описывается следующим уравнением:
 (3.6).
(3.6).
Именно этот показатель отражает давление, которое должно быть создано дыхательными мышцами (или аппаратом ИВЛ) в системе для преодоления статической эластической отдачи легких и грудной стенки при различных объемах легкого. В горизонтальном положении растяжимость грудной клетки уменьшается из-за давления органов брюшной полости на диафрагму (рис. 3.7).

Рис. 3.7. Кривые давление-объем для грудной клетки, легких и комплекса «грудная клетка + легкие» в вертикальном (А) и горизонтальном (Б) положении (по C. Scurr, S.Feldman, 1982)
При движении смеси газов по дыхательным путям возникает дополнительное сопротивление, называемое обычно неэластическим. Неэластическое сопротивление обусловлено в основном (70%) аэродинамическим (трение воздушной струи о стенки дыхательных путей), и в меньшей степени вязкостным (или деформационным, связанным с перемещением тканей при движении легких и грудной клетки) компонентами. Доля вязкостного сопротивления может заметно возрастать при значительном увеличении дыхательного объема. Наконец, незначительную долю составляет инерционное сопротивление, оказываемое массой легочных тканей и газа при возникающих ускорениях и замедлениях скорости дыхания. Весьма малое в обычных условиях, это сопротивление может возрастать при частом дыхании или даже стать главным при ИВЛ с высокой частотой дыхательных циклов.
В зависимости от ряда обстоятельств поток газа через систему трубок может быть трех типов: ламинарным, турбулентным или переходным. Ламинарный поток характеризуется слоями движущегося газа, параллельными как друг другу, так и стенкам трубок. Скорость движения газа наиболее высока в центре потока, к периферии она постепенно снижается. Для ламинарного потока существует следующая зависимость (прямая аналогия с законом Ома):
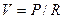 (3.7),
(3.7),
где: V - объемная скорость кровотока;
P - движущее давление;
R - сопротивление.
Ламинарный поток преобладает при низких скоростях газа и описывается законом Пуазейля:
 (3.8),
(3.8),
где: V - объемная скорость потока,
P - давление,
r - радиус трубки,
h - вязкость газа,
l - длина трубки.
Преобразуя уравнение, получаем:
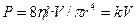 (3.9).
(3.9).
Таким образом, движущее давление пропорционально скорости потока. Уменьшение радиуса трубки наполовину снижает скорость потока в 16 раз, а увеличение же в два раза длины трубки приводит лишь к двукратному повышению сопротивления. Важно также, что на взаимоотношение между давлением и скоростью потока влияет вязкость, а не плотность флюида. Одна из особенностей полностью развитого ламинарного потока заключается в том, что частицы газа в центре трубки передвигаются со скоростью, в два раза превышающей среднюю. Распределение скоростей движения частиц по диаметру трубки называется профилем скорости (рис. 3.8).

Рис. 3.8. Типы воздушных потоков. А. Ламинарный. Б. Переходный (с завихрениями в области ветвлений). В. Турбулентный.
Турбулентный поток - более хаотичное движение газа вдоль трубки, преобладает при высоких скоростях объемного потока. Движущее давление для турбулентного потока пропорционально квадрату его скорости (P=kV2). Cопротивление потоку прямо пропорционально плотности газа и обратно пропорционально радиусу пятой степени:
 (3.10),
(3.10),
где: d - плотность газа,
r - радиус трубки.
Из этого следует, что зависимость турбулентного газового потока от радиуса дыхательных путей очень велика. Кроме того, вязкость при таком режиме не играет существенной роли, зато увеличение плотности газа приводит к увеличению сопротивления. Профиль скоростей с максимумом в области оси трубки для турбулентного потока не характерен. Турбулентное движение возникает при высоких потоках, в местах острых изгибов и разветвлений, а также при резком изменении диаметра дыхательных путей.
Переходный поток характеризуется завихрениями, возникающими в месте бифуркации трубки. В условиях дихотомического разветвления трахеобронхиального дерева переходный поток является важным паттерном потока в легких.
Будет ли поток через систему трубок турбулентным или ламинарным, можно предсказать, рассчитав число Рейнольдса (Re) - безразмерное число, связывающее среднюю скорость потока, плотность и вязкость газа, а также радиус трубки:
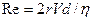 (3.11),
(3.11),
где: V- средняя скорость потока
d - плотность газа.
Когда Re превышает 2000, поток - турбулентный; когда Re менее 2000, поток - ламинарный. Из уравнения видно, что турбулентный поток легче возникает при высоких скоростях и в широких трубках. Кроме того, газы с низкой плотностью (например, гелий) имеют меньшую тенденцию к турбулентности. Ингаляция гелиево-кислородной смеси снижает риск формирования турбулентного потока, а также уменьшает сопротивление дыхательных путей при его возникновении. В норме общее сопротивление дыхательных путей составляет 0, 5-2 см вод. ст./л·с-1.
Таким образом, величина сопротивления ВП зависит от нескольких факторов: диаметра и длины бронхов и бронхиол; плотности и вязкости вдыхаемой смеси газов; скорости и характера тока газов и др. Кроме того, одним из важных факторов является объем легких. Чем он больше, тем большее растягивающее действие оказывает паренхима на ВП. В результате этого площадь поперечного сечения каждого из ВП увеличивается. Большая площадь поперечного сечения приводит к снижению сопротивления. При малом объеме легких, наоборот, отсутствие радиальной эластической тяги увеличивает вклад мелких дыхательных путей в формирование общего сопротивления. Этот феномен называют объем-зависимым закрытием дыхательных путей.
При патологии легких несколько механизмов может вызывать увеличение сопротивления. Так, например, при бронхиальной астме сужение ВП и, соответственно, повышение сопротивления может быть связано с сокращением гладкой мускулатуры бронхов, отеком бронхиальной слизистой или же с обструкцией секретом. Причиной сужения ВП и повышения сопротивления потоку могут быть также новообразование, гнойная мокрота при инфекционных заболеваниях. При эмфиземе утрата тканями эластичности и снижение растягивающего действия легочной паренхимы на ВП уменьшает их просвет и увеличивает сопротивление. Причиной повышения сопротивления может быть поток-зависимое закрытие дыхательных путей.
При больших объемах скорость экспираторного потока также напрямую зависит от плеврального давления, которое определяется давлением эластической отдачи грудной стенки и мышечным усилием. Движение газа из легких обеспечивается за счет наличия градиента давлений в альвеолах и на входе в ВП (атмосферное давление). Альвеолярное давление (Рalv) складывается из давления эластической отдачи легких (Pel) и плеврального давления (Ppl):
 (3.12).
(3.12).
В свою очередь давление эластической отдачи легких зависит от эластических свойств легочной ткани и степени растяжения легких (т.е. от объема легких). Соответственно, чем больше легочный объем, тем больше скорость экспираторного потока.
Однако при достижении определенной величины плеврального давления в условиях небольших легочных объемов (когда давление эластической отдачи легких становится небольшим), скорость потока остается постоянной, несмотря на дальнейшее возрастание мышечного усилия (рис. 3.9).

Рис. 3.9. Кривые поток-объем, полученные при выполнении с различным усилием инспираторного и экспираторного маневров, при объеме легких между остаточным объемом (ОО) и общей емкостью легких (ОЕЛ)
Это ограничение скорости на выдохе связано с компрессией дистальных ВП внутригрудным давлением (Рpl). На рис. 3.10 показано, что Рalv превышает Рpl только на величину давления эластической отдачи легких, независимо от величины Рpl. По мере движения газа по дистальным ВП, давление снижается за счет фрикционного сопротивления о стенки ВП. Может наступить момент, когда давление внутри и снаружи воздухопроводящего сегмента выравнивается (трансмуральное давление равно нулю - точка равного давления). За точкой равного давления трансмуральное давление становится отрицательным, и может произойти сужение этого сегмента ВП и снижение скорости экспираторного потока. Однако полного спадения ВП не происходит, так как общая окклюзия вновь повышает интрамуральное давление до уровня альвеолярного в точке перед окклюзированным сегментом. В результате этого сегмент вновь расширяется, поскольку Рalv на выдохе всегда превосходит Рpl, а трансмуральное давление снова становится положительным (т.е. давление внутри трубки больше, чем снаружи). Суммарный результат взаимодействия этих сил представляет собой резистор Старлинга, систему, в которой коллабируемый сегмент, критически сужаясь, лимитирует поток.

Рис. 3.10. Схема, иллюстрирующая сдавление дыхательных путей на форсированном выдохе
Ограничение потока воздуха за счет этого механизма еще более усиливается под действием нескольких факторов. Например, повышение сопротивления периферических воздухоносных путей увеличивает перепад давления в этих путях, и, следовательно, снижает внутрибронхиальное давление на выдохе. Другой фактор - низкое давление эластической отдачи при небольших исходных легочных объемах. При этом уменьшается движущаяся разница между внутриальвеолярным и внутриплевральным давлением. Кроме того, эта разница уменьшается при увеличении растяжимости легких (т.е. снижении давления эластической отдачи), например, при эмфиземе. С другой стороны, при малых объемах точка равного давления находится ближе к альвеолам, т.е в легко коллабируемых ВП, лишенных хрящевого каркаса. У здоровых людей механизмы ограничения потока воздуха действуют лишь при форсированном выдохе, а у больных с тяжелыми поражениями легких - даже при спокойном дыхании. Преждевременное окончание выдоха приводит к тому, что ФОЕ начинает превышать нормальные значения вдоха.
Для осуществления дыхательных движений необходимо преодолеть эластическое сопротивление грудной клетки и легких, неэластическое сопротивление дыхательных путей газовому потоку и сопротивление тканей. При этом дыхательные мышцы выполняют определенную работу. Около 50% затрачиваемой на это энергии накапливается в упругих структурах легких. Во время выдоха она высвобождается, что позволяет преодолеть сопротивление дыхательных путей. Увеличение сопротивления вдоху или выдоху компенсируется дополнительным усилием дыхательных мышц.
Наиболее распространенными способами измерения работы дыхания являются общая плетизмография или пневмотахография с измерением объемной скорости дыхания и внутрипищеводного давления. Работу обычно выражают в килограммометрах и рассчитывают ее либо на один дыхательный цикл, либо на 1 мин, либо на 1 л вентиляции. В нормальных условиях энергетическая «стоимость» спокойного дыхания у взрослого человека составляет в среднем 0, 5 кГм/мин.
Работу нередко оценивают косвенно по количеству кислорода, поглощаемого дыхательными мышцами. У здорового взрослого человека оно составляет весьма малую долю (3 - 4%) от общего потребления кислорода. Однако при значительном повышении сопротивления кислородная «стоимость» дыхания резко возрастает и становится критической.
Из множества комбинаций частоты и дыхательного объема организм «выбирает» ту, при которой необходимый объем альвеолярной вентиляции обеспечивается минимальной работой дыхания. Для взрослого человека без патологических изменений растяжимости и аэродинамического сопротивления работа дыхания будет минимальной при дыхательном объеме около 0, 5 л и частоте дыхания 14 - 16 в мин.
При повышенном аэродинамическом сопротивлении дыхательных путей наблюдается характерное снижение частоты спонтанного дыхания и увеличение дыхательного объема. Обратное явление происходит при увеличении эластического сопротивления, когда частота дыхания заметно увеличивается и может стать в 2 - 3 раза больше нормальной при уменьшении дыхательного объема.
Вентиляция легких и легочные объемы. Вентиляция легких - это смена воздуха в легких, совершаемая циклически при вдохе и выдохе. Легочную вентиляцию характеризуют прежде всего четыре основных легочных объема: дыхательный, резервный объем вдоха, резервный объем выдоха и остаточный объем. Вместе они составляют общую емкость легких. Сумма всех перечисленных объемов равняется максимальному объему, до которого могут быть расправлены легкие. Легочные емкости представляют собой сумму двух и более объемов.
Объем воздуха в легких и дыхательных путях зависит от конституционально-антропологических и возрастных характеристик человека, свойств легочной ткани, поверхностного натяжения альвеол, а также силы, развиваемой дыхательными мышцами. Для оценки вентиляционной функции легких, состояния дыхательных путей, изучения паттерна дыхания применяют различные методы исследования: пневморафию, спирометрию, спирографию и др. С помощью спирографа можно определить и записать величины легочных объемов воздуха, проходящих через воздухоносные пути человека (рис. 3.11).

Рис. 3.11. Спирограмма, показывающая статические легочные объемы и емкости (по J.F.Nunn, 1987)
При спокойном вдохе и выдохе через легкие проходит сравнительно небольшой объем воздуха (около 500 мл), который принято называть дыхательным объемом (ДО).
При форсированном (глубоком) вдохе человек может дополнительно вдохнуть еще определенный объем воздуха. Этот резервный объем вдоха (РОвд) - максимальный объем воздуха, который способен вдохнуть человек после спокойного вдоха. Величина резервного объема вдоха составляет у взрослого человека примерно 1, 8-2, 0 л.
После спокойного выдоха человек может дополнительно выдохнуть еще определенный объем воздуха. Это резервный объем выдоха (РОвыд), величина которого составляет в среднем 1, 2 - 1, 4 л.
Объем воздуха, который остается в легких после максимального выдоха и в легких мертвого человека - остаточный объем легких (ОО). Величина остаточного объема составляет 1, 2-1, 5 л.
Различают следующие емкости легких.
1. Общая емкость легких (ОЕЛ) - объем воздуха, находящегося в легких после максимального вдоха.
2. Жизненная емкость легких (ЖЕЛ) включает в себя дыхательный объем, резервный объем вдоха, резервный объем выдоха. ЖЕЛ - это объем воздуха, выдохнутого из легких после максимального вдоха при максимальном выдохе (ЖЕЛ=ОЕЛ-ОО); ЖЕЛ составляет у мужчин 3, 5 - 5, 0 л, у женщин - 3, 0-4, 0 л.
3. Емкость вдоха (Евд) равна сумме дыхательного объема и резервного объема вдоха, составляет в среднем 2, 0 - 2, 5 л.
4. Функциональная остаточная емкость (ФОЕ) - объем воздуха в легких после спокойного выдоха. В легких при спокойном вдохе и выдохе постоянно содержится примерно 2500 мл воздуха, заполняющего альвеолы и нижние дыхательные пути. Благодаря этому газовый состав альвеолярного воздуха сохраняется на постоянном уровне.
Объем легочной вентиляции удобно определять как объем газа, поступающего в дыхательные пути и покидающего их за определенный отрезок времени. Минутный объем дыхания (МОД) - объем воздуха, проходящий через легкие за одну минуту. Величина легочной вентиляции определяется глубиной дыхания и частотой дыхательных движений. В покое частота дыхательных движений человека составляет примерно 16 в мин (" эйпноэ" или " хорошее дыхание"), а объем выдыхаемого воздуха - около 500 мл. Умножив частоту дыхания в минуту на величину дыхательного объема, получим МОД, который у человека в покое составляет в среднем 8 л/мин. При этом акт вдоха проходит несколько быстрее, чем акт выдоха.
Прежде чем поток вдыхаемого воздуха достигнет альвеолярно-капиллярной мембраны, он проходит по огромному количеству ВП, расположенных между насосом или ротовой полостью и альвеолами. Распределение дыхательного объема по проводящим ВП и газообменивающим зонам оказывает глубокое влияние на дыхательную функцию. В газообмене может участвовать только та часть дыхательного объема воздуха, которая попадает в нормально перфузируемые альвеолы. Поэтому наиболее важным показателем легочной вентиляции является объем альвеолярной вентиляции (VА). Остальная часть общего дыхательного объема (VT) является вентиляцией так называемого мертвого пространства (VD). Объем альвеолярного пространства можно вычислить по формуле:
 (3.13).
(3.13).
Мертвое пространство включает объем дыхательных путей, в которых не происходит газообмен (анатомическое мертвое пространство), и объем неперфузируемых альвеол (альвеолярное мертвое пространство). Сумма анатомического и альвеолярного мертвого пространства называется физиологическим мертвым пространством. В норме у взрослого человека при вертикальном положении тела мертвое пространство равно 150 мл (примерно 2 мл/кг) и практически состоит только из анатомического мертвого пространства. Надо иметь в виду, что фактический объем анатомического мертвого пространства может варьировать в зависимости от способа осуществления ИВЛ (через маску, мундштук, трахеальную трубку, трахеостомическую канюлю) и от объема используемых указанных деталей.
У здорового человека в состоянии покоя альвеолярное мертвое пространство весьма невелико, но при некоторых патологических состояниях - при гиповолемии, легочной эмболии или эмфиземе могут возникать очаги - зоны альвеолярного мертвого пространства. Основной причиной увеличения отношения мертвого пространства к дыхательному объему в таких ситуациях является значительное снижение или полное отсутствие кровотока в вентилируемых альвеолах:
 (3.14).
(3.14).
Уравнение 3.14, известное как уравнение Бора, показывает, что отношение мертвого пространства к дыхательному объему может быть рассчитано как частное от деления разности альвеолярного PCO2 и выдыхаемого воздуха (PeCO2) на альвеолярное PCO2. Поскольку альвеолярное PCO2 практически совпадает с артериальным PCO2, VD/VT может быть рассчитано с помощью одновременного измерения PCO2 в пробах артериальной крови (PaCO2) и выдыхаемого газа.
Скорость образования СО2 (VCO2) у здорового человека массой 70 кг в состоянии покоя составляет около 200 мл в 1мин. Альвеолярное напряжение углекислого газа (РAСО2) отражает баланс между общей выработкой (продукцией) углекислого газа (VCO2) и альвеолярной вентиляцией (элиминацией СО2):
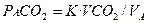 (3.15),
(3.15),
где: VA - альвеолярная вентиляция,
К - константа, равная 0, 863.
Система регуляции дыхания «установлена» на поддержание PCO2 в артериальной крови на уровне 40 мм рт. ст. Уравнение показывает, что при постоянной скорости образования двуокиси углерода РCO2 изменяется обратно пропорционально альвеолярной вентиляции.
Подобно тому, как РаCO2 определяется балансом между продукцией СО2 и альвеолярной вентиляцией, альвеолярное РO2 является функцией скорости поглощения кислорода через альвеолярно-капиллярную мембрану и альвеолярной вентиляции. Поскольку парциальные давления азота и водяного пара в альвеолах постоянны, РАО2 и РАСО2 изменяются реципроктно по отношению друг другу в зависимости от изменений альвеолярной вентиляции.
Сумма парциальных давлений О2, СО2, N2 и водяного пара постоянна, парциальное давление О2 либо СО2 может быть рассчитано, если одно из них известно. Расчет основывается на уравнении альвеолярного газа
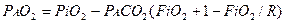 (3.16),
(3.16),
где: РiО2 - давление кислорода во вдыхаемом газе;
FiO2 - фракционная концентрация О2 во вдыхаемом газе;
R - дыхательное газообменное соотношение.
R - дыхательное газообменное соотношение, выражает скорость выделения СО2 относительно скорости поглощения О2, т.е. R=VCO2/VO2. В устойчивом состоянии организма дыхательное газообменное соотношение равно дыхательному коэффициенту (RQ), который описывает отношение продукции двуокиси углерода к потреблению кислорода на клеточном уровне. Это соотношение зависит от того, что преимущественно используется в организме в качестве источников энергии - углеводы или жиры. В процессе метаболизма 1г углеводов выделяется больше СО2.
Легкие довольно разнородны с точки зрения региональных механических свойств ВП и паренхимы, что является причиной неравномерного распределения в них воздуха. У здорового человека в положении стоя имеется градиент плеврального давления между верхушкой и основанием легкого. Плевральное давление наибольшее (т.е. наиболее отрицательное) у верхушки легких и наименьшее (т.е. наименее отрицательное) у основания (рис. 3.12). Градиент составляет около 0, 25 см вод. ст. на каждый сантиметр высоты. Поскольку транспульмональное давление равно Рalv-Ppl, то его величина на верхушке больше, чем у основания легких. В результате альвеолы из различных зон оказываются в разных точках кривой объем- давление. Альвеолы в верхних отделах легких из-за более высокого транспульмонального давления расправлены почти максимально, относительно нерастяжимы и значительно меньше увеличиваются в объеме во время вдоха. И наоборот, альвеолы в нижних отделах легких благодаря более низкому транспульмональному давлению более растяжимы и больше увеличиваются во время вдоха. Иными словами, при низком исходном объеме легкие легче раздуть, чем при высоком, так как по мере их расширения падает растяжимость. Статическая растяжимость выше в нижних областях легких, они занимают больший объем и, соответственно, там распределяется большая часть дыхательного объема. Фактически данное обстоятельство повышает эффективность газообмена, поскольку легочный кровоток также преобладает у основания легких.

Рис. 3.12. Влияние силы тяжести на давление в плевральной полости и растяжимость альвеол при вертикальном положении тела
Сопротивление дыхательных путей также способствует возникновению регионарных различий в легочной вентиляции. Конечный альвеолярный объем при вдохе определяется исключительно растяжимостью только в том гипотетическом случае, если время вдоха не ограничено. В действительности же время вдоха лимитировано частотой дыхания и временем, необходимым для выдоха. Следовательно, слишком короткое время вдоха не позволит альвеолам достичь ожидаемого объема. В связи с наличием различия в податливости различных альвеол, а также резистентности дыхательных путей в различных зонах легкого, регионарное время заполнения альвеол различное.
Расправление легких во время вдоха можно описать математически с использованием постоянной времени - «t»:
 (3.17).
(3.17).
Время, соответствующее 1t - это время, необходимое для расправления альвеолы приблизительно на 60% от максимального объема. Расправление на 99% требует времени, равного 4t.
Регионарное снижение растяжимости легких или увеличение резистентности дыхательных путей приводит к возрастанию неравномерности вентиляции, а также могут стать причиной асинхронного заполнения альвеол во время вдоха. Некоторые альвеолы продолжают заполняться и тогда, когда из других альвеол газ уже начал выходить.
Легочное кровообращение. Малый круг кровообращения представляет собой контур большого объема с низким сопротивлением, «функционально» расположенный между правой и левой половинами сердца. В отличие от кровообращения любого другого органа, малый круг должен вмешать весь объем сердечного выброса как в состоянии покоя, так и при напряжении. Из 5 л крови, протекающих через легкие за одну минуту, в легочных капиллярах одномоментно находится и участвует в газообмене только 70-100 мл. Этот небольшой объем крови образует на альвеолокапиллярной мембране пленку площадью 50-100 м2 и толщиной в один эритроцит. Емкость капилляров легких относительно постоянна, но общий внутрилегочный объем крови может изменяться от 500 до 1000 мл. Внутрилегочный объем крови незначительно увеличивается при каждом вдохе (при самостоятельном дыхании) и во время сердечной систолы.
Большинство легочных вен обладают тонкими сжимаемыми и растяжимыми стенками, легко поддающимися воздействию как внутрисосудистого, так и внесосудистого давлений. При напряжении происходит расширение функционирующих и включение в циркуляцию ранее нефункционирующих сосудов. Это позволяет сосудистому руслу легких пропускать возросший сердечный выброс при весьма незначительном повышении давления в легочной артерии. У здорового взрослого человека в состоянии покоя на уровне моря среднее давление в легочной артерии обычно составляет 9-15 мм рт. ст. Систолическое и диастолическое давление - от 15 до 25 мм рт. ст. и от 5 до 10 мм рт. ст. соответственно.
Увеличение сердечного выброса или давления в легочной артерии сопровождается снижением легочного сосудистого сопротивления. Это снижение нелинейно: его степень зависит от вазомоторного тонуса, существовавшего до повышения сердечного выброса, а также от уровня давления в легочной артерии и величины кровотока.
Легочный кровоток так же неравномерен, как и вентиляция. В частности, на его распределение влияют изменение позы и физическая нагрузка. В нижерасположенные отделы легких поступает крови больше, чем в вышерасположенные. Например, при вертикальной позиции кровоток минимален в верхушках, в положении лежа на спине - в вентральных отделах легких. Неравномерное распределение легочного кровотока можно объяснить различиями гидростатического давления в кровеносных сосудах. Если рассматривать легочную артериальную систему как единый столб крови высотой около 30 см, то разница в давлении между его вершиной и основанием составит примерно 30 см вод. ст., или 23 мм рт. ст. Поскольку в малом круге давление крови невелико, такая разница довольно существенна. В результате действия силы тяжести создается градиент внутрисосудистого давления, составляющий 1 см вод. ст. на каждый сантиметр высоты легкого.
При умеренной физической нагрузке кровоток в верхних и нижних отделах увеличивается, и регионарные различия его распределения сглаживаются.
В каждом легком условно принято выделять три зоны - в зависимости от соотношения альвеолярного (Рalv), артериального (Ра) и венозного (Pv) давлений (рис. 3.13).

Рис. 3.13. Модель, демонстрирующая неравномерность распределения легочного кровотока в трех зонах легкого
Первая зона (верхняя) определяется как область, где альвеолярное давление (Раlv) больше давления в легочной артерии (Рра), которое в свою очередь, превосходит легочное венозное давление (Рalv> Pa> Pv). Эта зона находится в верхних отделах легких и представляет собой альвеолярное мертвое пространство, потому что здесь давление в альвеолах сжимает легочные капилляры, а кровоток минимальный. Верхушка вертикально расположенного легкого перфузируется только за счет пульсирующего характера кровотока в легочной артерии.
В средней зоне (зона 2) давление в легочной артерии превышает альвеолярное, которое в свою очередь больше, чем давление в венозном русле малого круга кровообращения (Ppa> Palv> Ppv). Вследствие этого кровоток не определяется обычным градиентом между средним давлением в легочной артерии и альвеолярным давлением. Изменяющиеся отношения между альвеолярным и сосудистым давлениями попеременно смещают давление оттока в диапозоне между альвеолярным и венозным, создавая так называемый резистор Старлинга. Следовательно, кровоток через капилляры зоны 2 выглядит прерывистым благодаря каналам, которые открыты, когда венозное давление превышает альвеолярное, и закрыты, когда альвеолярное давление превосходит легочное венозное.
В зоне 3 легочный капиллярный кровоток непрерывен и определяется артериально-венозным градиентом давления. В этом случае обычные расчеты легочного сосудистого сопротивления становятся правомерными.
При малом объеме легких большое значение имеет сопротивление внеальвеолярных сосудов. В этих условиях снижается регионарный кровоток, причем преимущественно в области оснований легких, где легочная паренхима расправлена слабее всего. Это дает основание говорить и о четвертой зоне, в которой сопротивление кровотоку создают, как полагают, экстраальвеолярные, а не альвеолярные сосуды. Она исчезает с глубоким вдохом предположительно из-за выпрямления этих сосудов при расправлении легких.
Описанные зоны являются функциональными, а не анатомическими структурами. Поверхности, разделяющие зоны не закреплены топографически и перемещаются по вертикали легких в соответствии с изменениями отношений между легочным артериальным, легочным венозным и альвеолярными давлениями.
В регуляции сосудистого тонуса принимают участие как вегетативная нервная система, так и местные факторы, причем последние более значимы. Наиболее мощный стимул легочной вазоконстрикции - это гипоксия (в противоположность сосудорасширяющему действию гипоксии в большом круге кровообращения).Гипоксическая легочная вазоконстрикция, как реакция на альвеолярную гипоксию, приводит к заметному сужению прилегающих к альвеолам прекапиллярных мышечных легочных артерий и артериол. Вазоконстрикция происходит как при гипоксии в легочной артерии (в смешанной венозной крови), так и при альвеолярной гипоксии. Однако стимулирующий эффект последней более выражен. Медиаторы, вовлеченные в гипоксическую легочную вазоконстрикцию, пока полностью не идентифицированы. Этот феномен возникает либо благодаря прямому действию гипоксии на легочные сосуды, либо за счет преобладания выработки сосудосуживающих лейкотриенов над продукцией сосудорасширяющих простагландинов (простагландин I2). Возможно, гипоксия подавляет образование оксида азота (NO). В случае локальной альвеолярной гипоксии (как при пневмонии или региональном ателектазе) легочная вазоконстрикция тоже локализуется, отводя кровоток от гипоксических областей и уменьшая степень вентиляционно-перфузионного несоответствия. Однако при диффузном характере альвеолярной гипоксии возникающая легочная вазоконстрикция воздействует на легкое в целом. Например, при хронической обструктивной болезни легких гипоксическая легочная вазоконстрикция является компонентом повышения сосудистого сопротивления легких.
Гипероксия не оказывает существенного влияния на легочное кровообращение у здоровых людей. Значительная ацидемия (pH< 7, 2) вызывает легочную вазоконстрикцию. У человека ацидемия действует синергически с гипоксией. Значительная алкалемия (pH> 7, 5) уменьшает сужение сосудов в ответ на гипоксию. В отличие от гипоксемиии, гиперкапния, по-видимому, способствует легочной гипертензии, вызывая ацидемию, а не прямую вазоконстрикцию.
Вентиляционно-перфузионные отношения. Количественная связь между вентиляцией и перфузией выражается вентиляционно-перфузионным отношением. В норме альвеолярная вентиляция (V) составляет 4 л/мин, легочный капиллярный кровоток (Q) - 5 л/мин, а их соотношение V/Q - соответственно 0, 8. Апикально-базальные градиенты кровотока и вентиляции совпадают по направлению, но величина изменений вентиляции и перфузии от верхушки к основанию различна. Кровоток к основанию возрастает в большей степени, поэтому в апикальных отделах легких V/Q выше, чем в базальных. Альвеолы с V/Q менее единицы обеспечивают нормальную разницу между идеальным средним РАО2 и РаО2, т.е. альвеолярно-артериальную разницу по кислороду. В норме эта разница составляет от 5 до 10 мм рт. ст. у здоровых молодых людей, и может возрасти до 20 мм рт. ст. у здоровых пожилых людей.
Грубое нарушение соответствия вентиляции и перфузии сопровождается развитием дыхательной недостаточности. Глубина патофизиологических воздействий на артериальную оксигенацию нарушенных вентиляционно-перфузионных отношений намного превосходит воздействия других механизмов развития гипоксемии, включая гиповентиляцию, диффузионный блок и шунтирование.
Для отдельной легочной единицы (комплекс " альвеола-капилляр") V/Q может варьировать от 0 (отсутствие вентиляции) до бесконечности V/Q=¥ (отсутствие кровотока). Первое состояние представляет собой внутрилегочный шунт, второе - альвеолярное мертвое пространство.
В физиологии дыхания под шунтированием понимают возврат десатурированной смешанной венозной крови из правых отделов сердца в левые без насыщения кислородом в легких. Этот тип шунта обозначают как шунт «справа-налево», он приводит к снижению (" разбавлению") содержания кислорода в артериальной крови. Физиологический шунт - понятие, используемое для количественного описания воздействия как абсолютного (анатомического) шунта, так и зон с низким V/Q. В норме физиологический шунт составляет менее 5% сердечного выброса. Под абсолютными шунтами понимают анатомические шунты и те легочные единицы, где V/Q равно нулю. Относительный шунт - участок легкого с низким, но не нулевым значением V/Q. С практической точки зрения, гипоксемию, обусловленную относительным шунтом, можно частично корригировать, увеличив концентрацию кислорода во вдыхаемой смеси. При абсолютном шунте гипоксемию таким способом уменьшить нельзя.
Физиологический шунт рассчитывают, использую уравнение шунта:
 3.18),
3.18),
где: Qs/Qt - фракция шунтируемой крови,
Сс'О2 - содержание кислорода в легочной капиллярной крови,
СаО2; - содержание кислорода в артериальной крови,
CvO2 - содержание кислорода в смешанной венозной крови.
Фракцию шунтируемой крови (Qs/Qt) можно рассчитать в клинических условиях, если измерить парциальное давление кислорода и насыщение гемоглобина кислородом в артериальной и смешанной венозной крови. Для получения образца смешанной венозной крови необходима катетеризация легочной артерии. Для вычисления парциального давления кислорода в крови конечных легочных капилляров используют уравнение альвеолярного газа. Принято, что при FiO2> 0, 21 кровь конечных легочных капилляров насыщена кислородом на 100%.
Хотя альвеолярные единицы с низким V/Q обычно вызывают уменьшение PaO2, в редких случаях они способствуют повышению PaCO2. Это явление не связано с большей растворимостью СО2 по сравнению с О2, поскольку в норме диффузионных препятствий поглощению О2 не существует. Люди с умеренным увеличением фракции альвеол с высоким V/Q без труда повышают общую вентиляцию и выводят больше СО2 из других легочных единиц, компенсируя этим дополнительное мертвое пространство. Этот эффект возможен благодаря линейности кривой диссоциации СО2-гемоглобина (т.е. содержание СО2 в крови линейно связано с PaCO2).
Подобного компенсаторного ответа на гипоксемию, возникающую из-за наличия альвеол с низким V/Q, не существует. Хотя увеличение общей вентиляции повышает PАO2 в альвеолах с V/Q> 1, увеличение содержания О2 в конечно капиллярной крови минимально. Оно не компенсирует вклад десатурированной крови, оттекающей от альвеол с низким V/Q.
Теоретически физиологический эффект альвеол с V/Q больше единицы, но не с бесконечной величиной, может быть описан как функциональный эквивалент дополнительного мертвого пространства, т.е. «альвеолярного мертвого пространства». Воздействие единиц с высоким V/Q рассчитывается с помощью уравнения Бора (3.13).
Обмен газов в легких. Кинетическая энергия всех молекул атмосферного газа создает атмосферное или барометрическое давление. Давление плевральное или альвеолярное обычно выражают относительно атмосферного и называют манометрическим давлением.
Атмосферный воздух представляет собой смесь газов: азота, кислорода, углекислого газа, водяных паров. Количество аргона и двуокиси углерода в нем очень мало, а давление водяного пара при нормальных условиях окружающей среды невелико. Поэтому в практических целях атмосферный воздух можно рассматривать как смесь 21% кислорода и 79% азота (FiO2 - 0, 21 и FiN2 - 0, 79 - фракционные концентрации кислорода и азота соответственно).
В газовой смеси кинетическая энергия каждого газа создает давление, известное как парциальное давление газа. Смесь газов, находящаяся в резервуаре, оказывает на его стенки общее давление, равное сумме парциальных давлений всех газов газовой смеси (закон Дальтона).
Давление водяного пара во вдыхаемом воздухе, который нагревается до температуры тела и полностью увлажняется, составляет 47 мм рт.ст. Обычно фракционную концентрацию газа рассчитывают после вычитания давления водяного пара (т.е. как «сухой газ»). Парциальное давление газа представляет собой произведение его фракционной концентрации и общего давления «сухой» смеси.
Движение газа через альвеолярно-капиллярную мембрану происходит путем диффузии, согласно закону Фика. В соответствии с этим законом скорость переноса газа через тканевую поверхность или «мембрану» прямо пропорциональна разнице парциального давления газа по обе стороны мембраны и константе мембраны, известной как диффузионная способность (Dм):
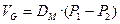 (3.19),
(3.19),
где: VG - скорость переноса газа через тканевую поверхность,
P1 - парциальное давление газа по одну сторону тканевой поверхности,
P2- парциальное давление газа по другую сторону тканевой поверхности.
Диффузионная способность, в свою очередь, состоит из нескольких компонентов, включая растворимость газа в ткани (a), площадь тканевой поверхности (А), ее толщину (d) и молекулярную массу газа (МM):
 (3.20),
(3.20),
где: k - константа.
Соединяя обе формулы, получаем:
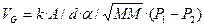 (3.21).
(3.21).
Из последнего уравнения следует, что для данного газа скорость его диффузии через альвеолярно-капиллярную мембрану возрастает: а) с увеличением площади поверхности мембраны, растворимости и градиента давления газа по обе стороны мембраны; б) с уменьшением толщины мембраны и молекулярного веса газа.
Не следует представлять диффузионную способность легких (Dм) как некую константную максимальную величину, характеризующую исключительно «пропускную способность» альвеолокапиллярной мембраны. Прежде всего, это конкретная величина, относящаяся к данным условиям функционирования легких, а кроме того, она характеризует диффузионную способность не только альвеоло-капиллярной мембраны, но всей легочной системы в целом.
Большая общая площадь и малая толщина (0, 4-0, 5 мкм) альвеолярно-капиллярной мембраны создают чрезвычайно благоприятные условия для диффузии кислорода. Усиленное связывание кислорода с гемоглобином при насыщении свыше 80% также способствует его диффузии. В нормальных условиях покоя время транзита эритроцита через легочной капилляр составляет около 0, 75 с. Кровь, протекающая по легочному капилляру, полностью оксигенируется за время, в течение которого эритроцит преодолевает одну треть длины капилляра. Напряжение кислорода в смешанной венозной крови поднимается с 40 мм рт.ст. до величины альвеолярного 100 мм рт.ст.
Связывание кислорода с гемоглобином - главный фактор, ограничивающий скорость перехода О2 из альвеолярного газа в кровь.Поэтому диффузионная способность легких зависит не только от диффузионных свойств альвеолярно-капиллярной мембраны, но также и от величины легочного кровотока. В норме поглощение кислорода кровью лимитируется главным образом скоростью легочного кровотока, а не его диффузией через альвелярно-капиллярную мембрану.
Нарушения диффузии возникают редко. Их причиной могут стать: расстройства вентиляционно-перфузионных отношений; обширная деструкция альвеолярно-капиллярной мембраны с увеличением так называемого расстояния диффузии (утолщение мембран при фиброзе легких, склерозе легочных сосудов, отеке легких, интерстициальной пневмонии и др.); уменьшение поверхности, через которую осуществляется диффузия (резекция легочной ткани). Нарушение транспорта кислорода вследствие недостаточного времени капиллярного транзита усиливаются при повышенном потреблении кислорода и увеличении сердечного выброса (например, при физической нагрузке).
Поскольку растворимость СО2 в тканях примерно в 20 раз больше, чем О2, то и скорость диффузии СО2 через альвеолярно-капиллярную мембрану в 20 раз выше. Поэтому система в целом располагает значительными резервами относительно диффузии СО2, и незначительные изменения в состоянии паренхимы легких не сопровождаются появлением артериально-альвеолярного градиента СО2.